| UN ENFOQUE ACTUAL SOBRE EL PIE DIABÉTICO :: Información profesional | |
| Perspectiva | |
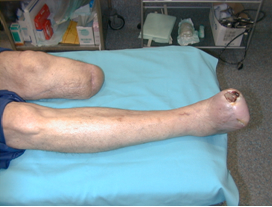 El “pie diabético” es un síndrome que engloba las alteraciones anatómicas y/o funcionales que ocurren en los pies de las personas con diabetes como consecuencia de su enfermedad metabólica. Representa una causa muy importante de morbi-mortalidad en este grupo de población ya que se estima que el 15% de los diabéticos desarrollará una lesión en sus pies a los largo de su vida1. El costo en pérdida de calidad de vida y de autoestima es difícil de calcular pero muy fácil de imaginar (Figura 1). Los costos económicos son enormes. En un estudio prospectivo realizado en Suecia 2 sobre 223 pacientes con infecciones profundas del pie, el 40% curó sin amputación, el 35% mediante una amputación menor, el 9% tras amputación mayor y el 16% no curó en el tiempo de seguimiento o falleció. El costo medio por paciente independientemente de la terapéutica utilizada fue de 27000 dólares americanos (al cambio de la corona sueca en 1997). En otro estudio realizado en USA 3, el costo de un paciente diabético ulcerado durante un periodo de 2 años fue de casi 28000 dólares americanos. En este trabajo, el costo de los pacientes ulcerados durante el año siguiente al diagnóstico fue 5,4 veces más que en el grupo control. Conscientes de la importancia de este problema, representantes de los departamentos gubernamentales de sanidad y organizaciones de pacientes de todos los países de Europa sostuvieron un encuentro con expertos en Diabetes bajo la tutela de las Oficina Regional de la Organización Mundial de la Salud para Europa y la Federación Internacional de Diabetes en St.Vincent, Italia del 10 al 12 de octubre de 1989. En aquella reunión se fijó, entre otros objetivos, reducir a la mitad las amputaciones en diabéticos. Existen estudios procedentes de Alemania 4,5 que son poco alentadores y en los cuales las tasas de amputación en diabéticos han permanecido invariables. Existen estudios realizados en España6, en el que se muestra una disminución en la incidencia de la ulceración mediante un programa de prevención. Aunque, teóricamente, si la úlcera es la antesala de la amputación, la disminución en la incidencia de úlceras llevaría aparejada una disminución en la incidencia de amputaciones, los trabajos realizados en Europa muestran discordancias a este respecto 7. En nuestro país también tenemos datos 8 que apuntan hacia una disminución en el número de amputaciones, aunque también es cierto que un estudio muy reciente refleja la importancia de que los registros de amputaciones deben ser prospectivos ya que con métodos retrospectivos la incidencia real de amputaciones puede ser infraestimada 9. Aún necesitamos en nuestro país un número mayor de estudios prospectivos con seguimientos a largo plazo para conocer nuestros resultados y poder demostrar a las autoridades sanitarias la importancia de esta desafiante complicación de la diabetes. El “pie diabético” es un síndrome que engloba las alteraciones anatómicas y/o funcionales que ocurren en los pies de las personas con diabetes como consecuencia de su enfermedad metabólica. Representa una causa muy importante de morbi-mortalidad en este grupo de población ya que se estima que el 15% de los diabéticos desarrollará una lesión en sus pies a los largo de su vida1. El costo en pérdida de calidad de vida y de autoestima es difícil de calcular pero muy fácil de imaginar (Figura 1). Los costos económicos son enormes. En un estudio prospectivo realizado en Suecia 2 sobre 223 pacientes con infecciones profundas del pie, el 40% curó sin amputación, el 35% mediante una amputación menor, el 9% tras amputación mayor y el 16% no curó en el tiempo de seguimiento o falleció. El costo medio por paciente independientemente de la terapéutica utilizada fue de 27000 dólares americanos (al cambio de la corona sueca en 1997). En otro estudio realizado en USA 3, el costo de un paciente diabético ulcerado durante un periodo de 2 años fue de casi 28000 dólares americanos. En este trabajo, el costo de los pacientes ulcerados durante el año siguiente al diagnóstico fue 5,4 veces más que en el grupo control. Conscientes de la importancia de este problema, representantes de los departamentos gubernamentales de sanidad y organizaciones de pacientes de todos los países de Europa sostuvieron un encuentro con expertos en Diabetes bajo la tutela de las Oficina Regional de la Organización Mundial de la Salud para Europa y la Federación Internacional de Diabetes en St.Vincent, Italia del 10 al 12 de octubre de 1989. En aquella reunión se fijó, entre otros objetivos, reducir a la mitad las amputaciones en diabéticos. Existen estudios procedentes de Alemania 4,5 que son poco alentadores y en los cuales las tasas de amputación en diabéticos han permanecido invariables. Existen estudios realizados en España6, en el que se muestra una disminución en la incidencia de la ulceración mediante un programa de prevención. Aunque, teóricamente, si la úlcera es la antesala de la amputación, la disminución en la incidencia de úlceras llevaría aparejada una disminución en la incidencia de amputaciones, los trabajos realizados en Europa muestran discordancias a este respecto 7. En nuestro país también tenemos datos 8 que apuntan hacia una disminución en el número de amputaciones, aunque también es cierto que un estudio muy reciente refleja la importancia de que los registros de amputaciones deben ser prospectivos ya que con métodos retrospectivos la incidencia real de amputaciones puede ser infraestimada 9. Aún necesitamos en nuestro país un número mayor de estudios prospectivos con seguimientos a largo plazo para conocer nuestros resultados y poder demostrar a las autoridades sanitarias la importancia de esta desafiante complicación de la diabetes. |
|
| ¿Dónde estamos fallando? | |
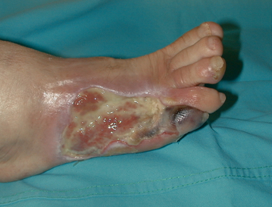 Las lesiones en los pies de las personas con diabetes mellitus han sido considerada durante años como una patología desagradecida, recidivante, con mala respuesta a cualquier tratamiento, inevitable y que acaba con la pérdida de la extremidad independientemente de la actitud que se adopte con el paciente (Figura 2). Aún persiste esa actitud en muchos profesionales que se ven “obligados” a tratar a estos pacientes en cualquier momento evolutivo. ¿Porqué este pesimismo? El origen de este pensamiento negativo en torno al pie diabético hay que buscarlo en la mala concepción de que cualquier problema que se presente en los pies del diabético tiene un origen vascular, y además, en un problema vascular sin solución: la obstrucción de los pequeños vasos como consecuencia de una arteriolosclerosis propiamente diabética. Este concepto de microangiopatía diabética obstructiva, derivado de los estudios de Goldenberg y Blumenthal10 hace 45 años, ha sido refutado posteriormente por numerosos estudios. Por desgracia aún sigue siendo citada a diario cuando aparece una lesión en un paciente con pulsos periféricos o se argumenta como causa de imposibilidad de revascularización. Las lesiones en los pies de las personas con diabetes mellitus han sido considerada durante años como una patología desagradecida, recidivante, con mala respuesta a cualquier tratamiento, inevitable y que acaba con la pérdida de la extremidad independientemente de la actitud que se adopte con el paciente (Figura 2). Aún persiste esa actitud en muchos profesionales que se ven “obligados” a tratar a estos pacientes en cualquier momento evolutivo. ¿Porqué este pesimismo? El origen de este pensamiento negativo en torno al pie diabético hay que buscarlo en la mala concepción de que cualquier problema que se presente en los pies del diabético tiene un origen vascular, y además, en un problema vascular sin solución: la obstrucción de los pequeños vasos como consecuencia de una arteriolosclerosis propiamente diabética. Este concepto de microangiopatía diabética obstructiva, derivado de los estudios de Goldenberg y Blumenthal10 hace 45 años, ha sido refutado posteriormente por numerosos estudios. Por desgracia aún sigue siendo citada a diario cuando aparece una lesión en un paciente con pulsos periféricos o se argumenta como causa de imposibilidad de revascularización. |
|
Otra razón importante de la refractariedad de las úlceras diabéticas a los tratamientos ha sido no abordarlas desde un punto de vista fisiopatológico y centrarse únicamente en el problema local. Este planteamiento lleva a un continuo cambio de apósitos, pomadas o antisépticos sin conseguir ningún tipo de respuesta terapéutica. Esto conduce al desánimo del paciente, del profesional implicado en su cuidado y al desprestigio del tratamiento local utilizado debido a que no consigue el efecto terapéutico adecuado. El tratamiento local es muy importante, y existen avances terapéuticos que nos van a ayudar a conseguir la cicatrización de nuestro paciente, pero no hay que olvidar nunca la la patogenia de la lesión. |
|
El pie diabético, debido a su complejidad, es una complicación de la diabetes que se va a beneficiar de un abordaje multidisciplinario. Es necesario que exista una buena comunicación entre todos los profesionales que tratan al paciente y que todos tengan la misma actitud frente a la enfermedad. En la práctica, la derivación a través de interconsultas a centros de referencia sobrecargados de trabajo y donde al pie diabético se entiende como una “patología menor”, ofrece más frustraciones que soluciones a los equipos de asistencia primaria ya que además los tratamientos que se pautan son poco estandarizados, y a veces basados en prácticas que están bastante alejadas de la evidencia científica. Esto es especialmente cierto cuando hablamos del tratamiento local de las heridas. Las Unidades de Pie Diabético, una posible solución a este desorden, son escasas y poco accesibles para la mayoría de los pacientes. El resultado es que existen muchos retrasos diagnósticos y terapéuticos que tienen como consecuencia una amputación del paciente. En mi serie personal, sobre un total de 287 pacientes con infección en el pie, en 140 de ellos (48%) se produjo un retraso diagnóstico y por tanto terapéutico. Estos 140 pacientes llevaban una media de evolución del proceso que motivó su ingreso de 48 dias (DE 63). |
|
Por último, aún nos queda bastante por avanzar en la prevención. Los diabéticos pasan por consultas sin quitarse sus zapatos y calcetines. En una encuesta que realizamos en nuestras Unidad a 116 pacientes consecutivos ingresados por problemas en el pie, solo al 20% de ellos su médico y/o enfermera le había mirado los pies antes de presentar la lesión. Estos pacientes llevaban una media de evolución de su enfermedad de 16,7 años (DE 9,3). Para la prevención es fundamental la educación del paciente, la detección de los factores de riesgo y la corrección de estos. Respecto a esto último, en nuestro país también tenemos dificultades añadidas. Muchos pacientes de alto riesgo, por ejemplo aquellos que han sufrido lesiones previas, se van a beneficiar de un estudio biomecánico del pie y el diseño de metodos de descarga ortopodológicos adecuados para evitar la reulceración (Figura 3). El paciente de la figura 3, al que se le pudo salvar el dedo después de un proceso osteomielítico, necesita un sistema, en este caso se ha realizado una silicona, que evite la reulceración. El profesional que conoce esta terapéutica, el podólogo, no se encuentra incluido en las prestaciones de nuestro sistema sanitario. La cirugía profiláctica, otra herramienta que podemos emplear en el diabético con pie insensible y deformidades, está poco estandarizada y carecemos de estudios que comparen su efectividad y ausencia de complicaciones frente a métodos conservadores. |
|
| Propuesta de abordaje diagnóstico/terapéutico | |
Sabemos que en la etiopatogenia del pie diabético intervienen la polineuropatía, la enfermedad vascular periférica que conduce a isquemia del pie y la inmunopatía que condiciona que el diabético con mal control metabólico de su enfermedad sea más propenso a las infecciones y que estas, una vez establecidas, sean más virulentas y refractarias al tratamiento. |
|
La neuropatía se encuentra implicada en el 80% de las úlceras diabéticas 11. La neuropatía sensorial hace que el pie se vuelva insensible ante estímulos normalmente dolorosos y de esta manera el paciente puede sufrir lesiones sin apreciarlo. La afectación de los nervios motores origina una atrofia de la musculatura intrínseca del pie y a un adelgazamiento de la almohadilla grasa que se encuentra bajo la cabeza de los metatarsianos. Como consecuencia de ello se producen deformidades de los pies y de los dedos y prominencia de las cabezas metatarsales. Estas deformidades dan lugar a zonas de elevada presión en las cabezas metatarsales. Inicialmente, se produce una hiperqueratosis que es la respuesta del organismo al aumento de presión, con posterioridad se producen hemorragias en el interior de la callosidad (Figura 4) y si la presión continúa entonces se produce la úlcera neuropática (Figura 5). |
|
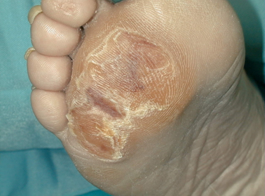 figura 4 |
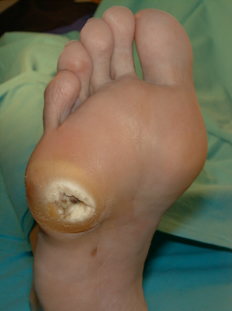 figura 5 |
Es necesario que coexista la insensibilidad junto a la elevada presión para que se produzca la úlcera ya que en los pacientes con artritis reumatoide no se producen úlceras a pesar de las elevadas presiones que sufre el pie a causa de sus deformidades. En el pie de Charcot en su fase crónica también se producen deformidades, sobre todo en el medio pie debido a la pérdida del arco plantar y adoptar la planta una forma “en mecedora”. La neuropatía autónoma tiene como consecuencia la pérdida de sudoración del pie, tornándose la piel seca, agrietada y con una marcada tendencia a la hiperqueratosis, lo que la hace más susceptible a la lesión. La enfermedad vascular periférica, la obstrucción arterial provocada por la arteriosclerosis que en los diabéticos tiene un desarrollo más acelerado y agresivo lleva a una disminución del aporte sanguíneo del pie. Esta isquemia va tener 2 consecuencias principalmente. En primer lugar, el pie isquémico es mucho más susceptible a lesionarse que el bien vascularizado.
Las lesiones isquémicas tienden a localizarse en las caras laterales y dorsal del pie a diferencia de las neuropáticas que son más frecuentes en la región plantar. El mecanismo desencadenante suele ser un pequeño traumatismo y bastante a menudo el roce con el calzado (Figura 6). En segundo lugar, las lesiones que se producen en el pie isquémico van a ser más resistentes a la cicatrización y por tanto en estos pacientes es absolutamente necesaria la valoración del cirujano vascular. |
|
La infección es un grave evento cuando se inocula en el pie del diabético y casi el 60% de las amputaciones de las extremidades inferiores que se practican en diabéticos están precedidas por una úlcera infectada en el pie 12. Cualquier herida en el pie del diabético, independientemente de su etiología, es una puerta de entrada a la infección. Podemos apreciar en la figura 7, como una úlcera neuropática plantar constituye una puerta de entrada a un proceso séptico muy importante, con celulitis intensa y edema de todo el pie (Figura 8). |
|
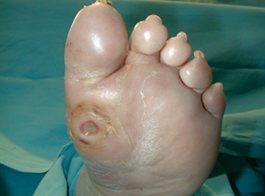 figura 7 |
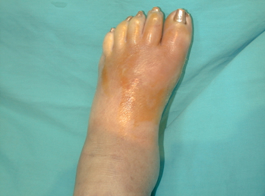 figura 8 |
Por tanto ya que conocemos que la infección puede complicar cualquier úlcera diabética comprometiendo la viabilidad de la extremidad, debemos conseguir la cicatrización en el menor tiempo posible controlando la proliferación bacteriana. Para llegar a un correcto diagnóstico de la lesión que presenta nuestro paciente recomiendo seguir el algoritmo diagnóstico de la figura 9. |
|
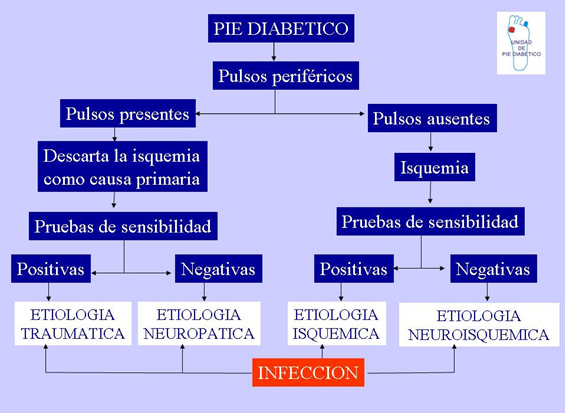 |
|
La primera maniobra que se debe realizar ante un paciente diabético con una lesión en el pie es la palpación de los pulsos periféricos. Si los pulsos están presentes, la isquemia queda descartada como causa de la lesión y su etiología va a ser neuropática o traumática. Si los pulsos están ausentes, la isquemia va a tener un papel tanto en la producción, resistencia al tratamiento, mantenimiento o empeoramiento de la misma. En estos casos tendriamos lesiones isquémicas puras o lesiones neuroisquémicas. Las lesiones neuropáticas constituyen un 60-70%, las neuroisquémicas el 15-20% y las isquémicas, otro 15-20%. Por tanto, podemos comprobar que el antiguo concepto que atribuía todas las úlceras diabéticas a problemas circulatorios es totalmente erróneo. La infección puede complicar cualquiera de estas lesiones etiopatogénicas primarias dando lugar a lesiones complicadas. El diagnóstico de infección va a ser eminentemente clínico y quedaría definido por la presencia de secrección purulenta o dos o más signos de inflamación: tumefacción, eritema, dolor, sensibilidad y aumento de temperatura 13. |
|
|
|
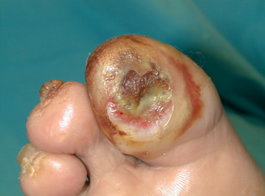
Los tratamientos antibióticos están bien establecidos y existe suficiente bibliografía basada en la evidencia sobre cuales son los más adecuados según la situación clínica del paciente. Sin embargo, la conducta quirúrgica varía según los centros y esto puede incluso explicar en parte las distintas tasa regionales de amputación 16. Por ejemplo, la osteomielitis que es criterio clásico de amputación puede ser manejada mediante un desbridamiento adecuado, resección del hueso infectado y un tratamiento local adecuado. En la figura 12 vemos un caso de osteomielitis. |
 |
Se realizó un desbridamiento y extirpación del hueso infectado (Figuras 13 y 14) cuya anatomía patológica confirmó la osteolisis. Posteriormente se emplearon apósitos con carbón y plata como tratamiento local (Figura 15) hasta conseguir la cicatrización total de la lesión (Figura 16). |
|
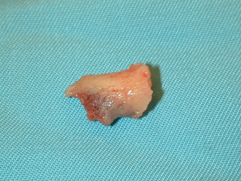 figura 13 |
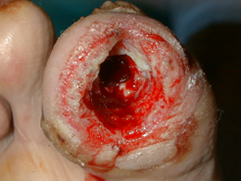 figura 14 |
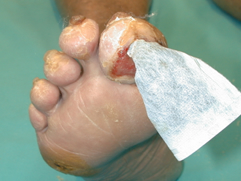 figura 15 |
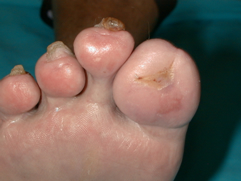 figura 16 |
Tan y col 17 demostraron una disminución de la tasa de amputaciones por encima del tobillo cuando las amputaciones menores y desbridamientos eran realizados en las primeras 72 horas de hospitalización. Esta conducta tampoco es aceptada de forma universal, y a veces los pacientes ingresan en servicios hospitalarios, incluso no quirúrgicos, donde además de ser inadecuadamente valorados 18 se intenta delimitar la zona de necrosis mediante antibioterapia cuando la única manera de delimitar el avance de la infección es en quirófano. Mi opinión es que estos pacientes constituyen una urgencia quirúrgica y esa es la conducta que personalmente he adoptado: prácticamente el 100% de los pacientes que ingresan en mi Unidad con pie séptico son intervenidos en las primeras 12 horas. Como adyuvantes en el manejo del pie diabético infectado han sido utilizadas terapias como la oxigenoterpia hiperbárica 19,20 o el factor estimulante de crecimiento de colonias granulocitarias 21,22 aunque no son tratamientos al alcance de todos los centros. En caso de que coexista isquemia, inicialmente será controlado el proceso séptico para posteriormente iniciar el estudio con vistas a aumentar el flujo de la extremidad. Si al realizar el diagnóstico del paciente con lesión no complicada, no presenta pulsos periféricos, el paciente ha de ser enviado al servicio de cirugía vascular más próximo. Es fundamental la opinión de estos expertos en el manejo del pie diabético con componente isquémico. |
|
| El tratamiento de la úlcera neuropática va a estar basado en las cuatro “D”: Desbridamiento, Desinfección, Descarga y Descartar osteomielitis. | |
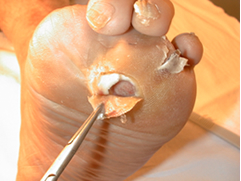
Típicamente, la úlcera neuropática plantar se encuentra rodeada de una importante hiperqueratosis que pone de manifiesto el papel que juegan las elevadas presiones en su patogenia. En algunas ocasiones estas hiperqueratosis o callosidades plantares se encuentran totalmente cavitadas. Toda esta hiperqueratosis ha de ser eliminada y dejar la úlcera a plano (Figura 17). Pueden existir esfacelos en el fondo ulceroso y debemos elegir el método que consideremos más idóneo para el desbridamiento: quirúrgico, autolítico, enzimático o combinado. En los últimos años ha existido un interés creciente por el uso de larvas o terapia Maggot para el desbridamiento de úlceras diabéticas 23. |
 |
La segunda D es la desinfección y ya hemos hablado de los signos de infección en cuyo caso, si no es amenazante de la extremidad puede colocarse antibioterapia y ser vigilado estrechamente de forma ambulatoria. Otra condición que nos podemos encontrar es el concepto de colonización crítica que significa que los microorganismos están interfiriendo con el proceso de cicatrización de la herida pero sin producir signos clínicos de infección 24 y existen indicios de que esto también ocurre en el pie diabético 25. En 284 paciente diabéticos con lesiones ulcerosas en los pies que hemos tratado, el tiempo de evolución medio de sus lesiones hasta su llegada a nuestra Unidad fue de 118 dias. Con estos tiempos de padecimiento de la lesión utilizamos medios de descontaminación de la herida y los apósitos con plata nos parecen una excelente opción. El objetivo de estos apósitos es la destrucción de los microorganismos mediante la exposición de los mismos a la acción biocida de la plata. |
|
La descarga, la tercera D, es la clave para conseguir la cicatrización de las úlceras neuropáticas plantares. Para los anglosajones, el gold estándar de la descarga es el yeso de contacto total debido a que produce una redistribución de las presiones del pie y además el cumplimiento del tratamiento es forzoso porque el paciente no se lo puede retirar. Como contrapartida, la herida no puede ser inspeccionada regularmente, requiere que sea colocado por alguien con experiencia y además puede producir lesiones en un pie neuropático. Aunque lo hemos utilizado en alguna ocasión utilizamos otras alternativas como los fieltros (Figura 18) en combinación con calzado posquirúrgico o los zapatos de medio pie (Figura 19). |
|
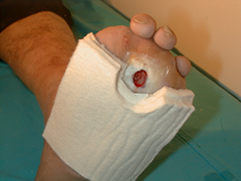 figura 18 |
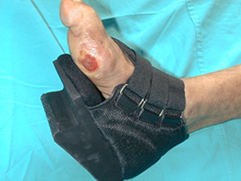 figura 19 |
Por último, en toda úlcera plantar debemos descartar la existencia de osteomielitis. Para ello, desde el punto de vista clínico debemos realizar la exploración de la herida. La palpación del hueso mediante un estilete esteril a través de la úlcera ha mostrado una sensibilidad del 66%, una especificidad del 85% y un valor predictivo positivo del 89% para el diagnóstico de osteomielitis 26. La radiografía simple del pie es obligada. Si la radiografía no muestra cambios sugestivos de osteomielitis y la exploración clínica lo sugiere, debemos repetir el estudio a los 7-10 dias ya que la radiografía sólo muestra anormalidades óseas relacionadas con la osteomielitis después de 10-20 dias de que la infección ósea se ha inoculado. |
|
| ¿Por qué no cicatriza nuestro paciente? | |
Las úlceras isquémicas o neuroisquémicas van a presentar una insuficiencia cicatricial debido a la falta de aporte sanguíneo y por esta razón la valoración del angiólogo es fundamental. Si la lesión es neuropática pura y no evoluciona satisfactoriamente hay que reconsiderar las 4 “D”. Si la descarga está siendo correctamente realizada y la herida ha sido descontaminada, hay que buscar el origen en el interior, casi siempre en la afectación osteoarticular. Han sido descritas en el pie diabético otras alteraciones a nivel molecular que podrían interferir con la cicatrización. Se ha encontrado en la úlceras crónicas en el pie un incremento de la actividad proteolítica e inactivación de los factores de crecimiento 27,28. En un reciente estudio 29 se encontró un incremento en la concentración de metaloproteinasas de la matriz junto a una disminución en la concentración de inhibidores tisulares de proteinasas cuando se compararon úlceras crónicas del pie versus heridas traumáticas. |
|
La utilización de apósitos bioabsorbibles de colágeno y celulosa oxidada y regenerada (Figura 20) inhiben este exceso de actividad proteolítica protegiendo y estimulando la actividad de los factores de crecimiento endógenos y así podemos acelerar el proceso de cicatrización. |
 |
| Conclusión | |
Hoy vamos conociendo cada vez más los factores que llevan al diabético a la pérdida de la extremidad. Cada vez son más numerosos los estudios, foros de debate, cursos y congresos dedicados a esta complicación de la diabetes y por ello, hoy más que nunca, debemos considerar cada amputación como un fracaso de nuestro sistema. Es, sin duda, la prevención la pieza clave que hay que potenciar, pero si esta falla, solo un abordaje multidisciplinario, científico y fundamentado conseguirá evitar la amputación y la lamentable pérdida de calidad de vida de nuestro pacien |
|
Dr. F. Javier Aragón Sánchez Jefe de Servicio de Cirugía |
|
| Bibliografia | |
1. American Diabetes Association. Diabetes 1996 vital statistic. Alexandria, VA: American Diabetes Association; 1996. 2. Tennvall G, Apelqvist J, Eneroth M. Cost of deep foot infections in patients with diabetes mellitus. Pharmacoeconomics 2000; 18: 225-238. 3. Ramsey SD, Newton K, Blough D et al. Incidence, outcome and costs of foot ulcera in patients with diabetes. Diabetes Care 1999; 22: 382-387. 4. Trautner C, Haastert B, Spraul M, Giani G, Berger M. Unchanged incidence of lower-limb amputations in a German City, 1990-1998. Diabetes Care. 2001 May;24:855-9. 5. Trautner C, Haastert B, Giani G, Berger M. Amputations and diabetes: a case-control study. Diabet Med. 2002 Jan;19:35-40. 6. Calle-Pascual AL, Duran A, Benedi A et al. Reduction in foot ulcer incidence: relation to compliance with a prophylactic foot care program. Diabetes Care. 2001 Feb;24:405-7. 7. Boulton AJM. The diabetic foot: from art to science. Diabetologia 2004; 47: 1343-1353. 8. Castell C, Tresserras R, De Lara N, Taberner JL. Diabetes mellitus. Evaluation of the objectives of the Health Plan for Catalonia for the year 2000. Med Clin (Barc). 2003;121 Suppl 1:42-6. 9. Rayman G, Krishnan ST, Baker NR et al. Are we underestimating diabetes-related lower-extremity amputation rates? Results and benefits of the first prospective study. Diabetes Care. 2004;27:1892-1896. 10. Goldenberg SG, Alex M, Joshi RA, Blumenthal HT. Nonatheromatous peripheral vascular disease of the lower extremity in diabetes mellitus. Diabetes 1959;8:261-73. 11. Boulton AJ. The diabetic foot: neuropathic in etiology. Diabet Med 1990; 7: 852-858. 12. Pecoraro RE, Ahroni JH, Boyko EJ, Stensel VL. Chronology and determinants of tissue repair in diabetic lower-extremity ulcers. Diabetes 1991; 40: 1305-1313. 13. Lipsky BA. A current approach to diabetic foot infections. Current Infectious Disease Reports 1999; 1: 253-260. 14. Gibbons GW, Eliopoulos GM. Infection of the diabetic foot. In: Kozak GP, Hoar CS, Rowbotham JL, et al., editors. Management of Diabetic Foot Problems. Philadelphia: WB Saunders; 1984. p.97. 15. Aragón Sánchez FJ, Lázaro Martínez JL, Ortiz Remacha PP et al. La infección en el pie del diabético, en Lázaro Martínez ed, El pie diabético, Barcelona, Ediciones Especializadas Europeas, 2003, 20-31. 16. Connelly J, Airey M, Chell S. Variation in clinical decision making is a partial explanation for geographical variation in lower extremity amputation rates. Br J Surg. 2001 Apr;88(4):529-35. 17. Tan Js et al. Can aggresive treatment of diabetes foot infections reduce the need for above-ankle amputations?. Clin Infect Dis 1996; 23: 286-291. 18. Edelson GW, Armstrong DG, Lavery LA, Caicco G. The acutely infected diabetic foot is not adequately evaluated in an inpatient setting. J Am Podiatr Med Assoc. 1997 Jun;87(6):260-5. 19. Wunderlich RP, Peters EJ, Lavery LA: Systemic hyperbaric oxygen therapy: lower-extremity wound healing and the diabetic foot. Diabetes Care 2000, 23:1551–1555. 20. Kalani M, Jorneskog G, Naderi N, et al.: Hyperbaric oxygen (HBO) therapy in treatment of diabetic foot ulcers. Long-term follow-up. J Diabetes Complications 2002, 16:153–158. 21. de Lalla F, Pellizzer G, Strazzabosco M et al. Randomized prospective controlled trial of recombinant granulocyte colony-stimulating factor as adjunctive therapy for limb-threatening diabetic foot infection. Antimicrob Agents Chemother. 2001;45:1094-1098. 22. Kastenbauer T, Hornlein B, Sokol G, Irsigler K. Evaluation of granulocyte-colony stimulating factor (Filgrastim) in infected diabetic foot ulcers. Diabetologia. 2003;46:27-30. 23. Sherman RA. Maggot therapy for treating diabetic foot ulcers unresponsive to conventional therapy. Diabetes Care 2003;26:446-451. 24. Bowler PG. The 105 bacterial growth guideline: Reassessing its clinical relevance in wound healing. Ostomy Wound Management 2003; 49: 44-53. 25. Browne AC, Vearncombe M, Sibbald RG. High bacterial load in asymptomatic diabetic patients with neurotrophic ulcers retards wound healing after application of dermagraft. Ostomy Wound Management 2001; 47: 44-49. 26. Grayson ML, Gibbons GW, Balogh K, Levin E, Karchmer AW. Probing to bone in infected pedal ulcers. A clinical sign of underlying osteomyelitis in diabetic patients. JAMA 1995; 273:721-723. 27. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med 1999;341:738-46. 28. Witte MB. General principles of wound healing. Surg Clin North Am 1997;77:509-28. 29. Lobmann R, Ambrosch A, Schultz G. Expression of matrix-metalloproteinases and their inhibitors in the wounds of diabetic and non-diabetic patients. Diabetologia. 2002l;45:1011-1016. |
|
|
|
|
| Unidad de Pie Diabético. Hospital La Paloma. Las Palmas de Gran Canaria ( España) draragon@piediabetico.net |
|
© Dr. F. Javier Aragón Sánchez
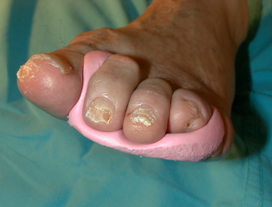
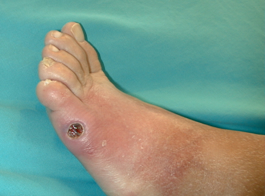
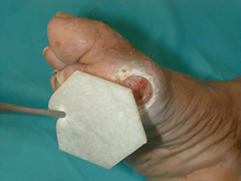
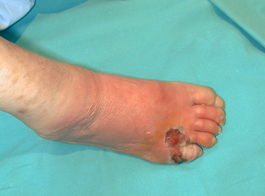 Una vez que tenemos realizado el diagnóstico correcto de la úlcera que presenta nuestro paciente, debemos iniciar el tratamiento. Este debe ser urgentemente iniciado en un centro con experiencia en el pie diabético en caso de que nos encontremos ante una infección amenazante de la extremidad. Estas se definen como aquellas profundas, con un área de celulitis de más de 2 cms, edema, linfangitis y que se acompañan frecuentemente de fiebre, leucocitosis e hiperglucemia
Una vez que tenemos realizado el diagnóstico correcto de la úlcera que presenta nuestro paciente, debemos iniciar el tratamiento. Este debe ser urgentemente iniciado en un centro con experiencia en el pie diabético en caso de que nos encontremos ante una infección amenazante de la extremidad. Estas se definen como aquellas profundas, con un área de celulitis de más de 2 cms, edema, linfangitis y que se acompañan frecuentemente de fiebre, leucocitosis e hiperglucemia